
フェノール資化性細菌の遺伝子検出例の紹介
●DBTでは、土壌・地下水汚染対策の一手法として、微生物を用いたTCE(トリクロロエチレン)分解の研究に取り組んでいます。
研究の一環として、分解担体としてのフェノール資化性細菌に着目し、これらの遺伝子判定方法を模索しています。
現在まで(05/01)に、
① フェノール資化性細菌群の分離と培養
② 全フェノール資化性細菌の遺伝子検出
③ TCE高親和性フェノール資化性細菌の遺伝子検出
④ TCE中低親和性フェノール資化性細菌の遺伝子検出
⑤ TCE低親和性フェノール資化性細菌の遺伝子検出
⑥ 全フェノール資化性細菌の遺伝子定量
に成功を修めています。これらの技術の内、①〜⑤はNEDOの研究報告内容を追試したもので、独自開発ではありません。
詳しくはNEDOの研究成果報告書を御覧ください。
『土壌汚染等修復技術開発 研究報告書』平成7年度〜平成12年度
●尚、遺伝子検出の基礎概念が解らない方は、本HPの環境学習のページにある【DNA解析の基礎知識】を参照してください。
 |
DNA解析の基礎知識 |
|
1.VOC汚染と微生物による分解・遺伝子モニタリング(バイオレメディエーション概論)
1−1.VOC分解の流れ
地下汚染物質の分類の一つにVOCが挙げられる。VOC(Volatile Organic Compounds)は揮発性有機化合物を指す言葉で、
ベンゼンやホルムアルデヒドなどの有機化合物のうち沸点が50℃〜260℃(WHO基準による)の物質の総称である。土壌・地
下水汚染で問題とされるVOCはテトラクロロエチレン(PCE)とその分解産物とされる9物質である。
PCEとその関連物質は比重が1より大きいため、地下に浸透すると帯水層の下に潜り込み、大気と隔絶されるために揮発
することなく長期間滞留する。一部は地下水に溶解し、飲料水を汚染する。可能であればPCEとその関連物質に汚染された
地下水を汲み上げて曝気することでこれらを大気に気散させる対策が採られる。
地下に浸透、滞留したPCEとその関連物質は、微生物によって分解可能なことが知られている。このプロセスは嫌気過程
と好気過程に分けられ、以下のような経路を持つと考えられている。
(1)嫌気プロセス
嫌気条件下ではPCEがTCEへと分解されるプロセスが特徴である。分解産物としてDCE(ジクロロエチレン)、塩化ビニル(VC)
が生成されるが、分解がこれらの過程で停止することが多く、有害物質の蓄積が問題とされている。
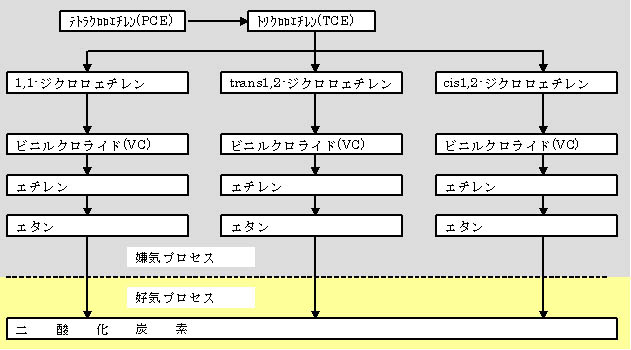
図1−1 塩素化エチレンの嫌気分解プロセス摸式
(2)好気プロセス
好気条件ではPCEは分解不可能とされている。しかしながらTCE以降の分解は速く、短期間に二酸化炭素と水にまで分解され、
嫌気プロセスで問題とされるDCE(ジクロロエチレン)、塩化ビニル(VC)などの生成や残留がない。
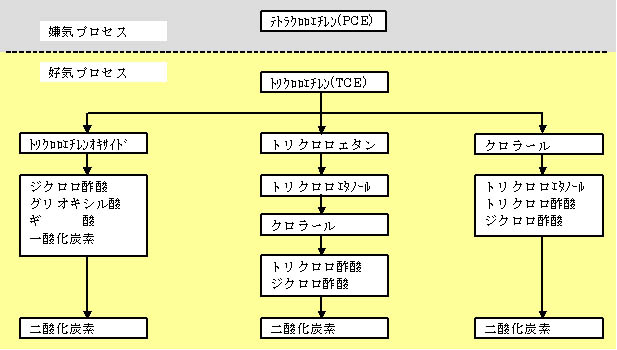
図1−2 塩素化エチレンの好気分解プロセス摸式
1−2.TCE汚染修復に関する微生物利用修復技術の現状
(1)TCE分解機構
これまでにTCE(トリクロロエチレン)を唯一の炭素源として利用・増殖する微生物の存在は知られていない。微生物によるTCEの分解
は専ら、メタン、フェノール、トルエン等を資化(酸化)する細菌群によって共代謝的(コメタボリズム)に分解される。
従って、有機塩素系化合物のBio-remediationは『メタン資化性細菌群』等の細菌群を活性化するために、その栄養となるメタ
ンと栄養塩をオンサイトに注入することを基本としている。この場合、汚染サイトに生息している微生物を活性化する方法と
外部から特異的微生物を持ちこむ二つの考え方がある。
(2)Bio-stimulateとBio-augment
Bio-stimulationは汚染サイトに生息している微生物を人工的に刺激し、目的とする機能微生物群を活性化することで汚染物
質を分解する手法である。利点としては、外部からの微生物を持ちこまないことで生物汚染の心配が軽減されること、欠点とし
ては、特異的機能微生物が生息していない場合(ほとんど有り得ない)や条件設定を失敗した場合には浄化が進まないことが挙
げられる。
Bio-augmentationは外部より特異的微生物を持ちこみ、汚染サイトに注入する手法である。但し、augment(拡大)はこれら
の微生物が遺伝子操作を受けているか否かや増殖刺激物質添加の有無について問うものではない。利点としては、増殖・分解環
境条件が既知であること、浄化開始前にメタン添加培養などで微生物を活性化できること(補助栄養をサイトに添加しない場合
もある)、が挙げられるが、PA(住民同意)を受け入れられ難いと言った欠点がある。
(3)in situとex situ
汚染土壌を浄化する場所によって、in situ bio-remediation(原位置修復)とex situ bio-remediation(外部処理修復)に
区別される。原位置修復はコスト的には安価で済むが、透水性の悪い地層では効果が期待できないことや、修復終了期限が明ら
かでない等の欠点がある。外部処理修復に関してはその逆のことが言える。何れにしても、Bio-remediationを実施しようとする
利点の多くが原位置修復にあるため、今後発展・普及するBio-remediationは、In situ Bio-stimulation(原位置刺激微生物修
復)であると考えられる。
1−3.メタン資化性細菌とフェノール資化性細菌の遺伝子モニタリング(NEDO報告より)
(1)メタン資化性細菌
メタン資化性細菌群の持つメタンモノオキシゲナーゼ(MMO)には、膜タンパクであるpMMOと可溶性タンパクであるsMMOの2タ
イプが存在する。全てのメタン資化性細菌はpMMOを保持しているが、一部のメタン資化性細菌はpMMOとsMMOを併せ持っている。
二つのMMOはいずれもTCEを分解することができるが、sMMOはpMMOに比べて分解能力が極めて高いことが知られている。従って、
バイオスティミュレーションによる地下水中のメタン資化性細菌の変動をモニタリングする場合、メタン資化性細菌群全体の変動
と同時にsMMOを持つメタン資化性細菌の変動も測定する必要がある。
pMMOの生産遺伝子とsMMOの生産遺伝子を検出可能であれば、メタン資化性細菌群を遺伝子の面からモニタリング可能となる。
pMMO遺伝子・・・・・・・・・・・・・全メタン資化性細菌群指標
sMMO遺伝子・・・・・・・・・・・・・主要メタン資化性細菌群指標
『NEDO研究報告書』の平成10年度報告では、まずsMMO遺伝子の検出(定性)に対し、met-1、met-4のプライマーペアーが目
的の遺伝子増幅可能なことが突きとめられた。次に、汚染サイトの試料より上記両遺伝子を検出する検討を加え、両遺伝子を検出、
定量可能なプライマーの開発に成功した。
① sMMO遺伝子検出プライマーペアー・・・mmoX1プライマー、mmoXr901プライマー
② pMMO遺伝子検出プライマーペアー・・・pmoA189プライマー、pmoA682プライマー
③ 外部標準遺伝子・・・・・・・・・・・・Methylococcus capsulatus strain Bath(ATCC33009)
Methylomonas sp. strain KSWⅢ
平成11年度の研究では新たに設計したプライマーにより両遺伝子の検出、定量を成功させている。
① sMMO遺伝子検出プライマーペアー・・・mmoX1-24プライマー、mmoXr933プライマー
② pMMO遺伝子検出プライマーペアー・・・pmof1プライマー、pmorプライマー
③ 外部標準遺伝子・・・・・・・・・・・ Methylomonas sp. strain KSWⅢ
(2)フェノール資化性細菌
Hopkinsらの研究によれば、TCEの分解誘導基質として、トルエン>フェノール>メタン>アンモニアの順にTCE分解が認めら
れており、トルエンに比べて毒性、揮発性が低く、水への溶解性に優れたフェノールを誘導基質として選択している。
『NEDO研究報告書』の平成9年度報告では、まずフェノール資化性細菌群の検出(定性)に対し、既知のフェノール資化性細菌
数種の共通保存領域を見出し、プライマー設計とPCRを実行した。その結果、2つのプライマーペアーで保存域の増幅が可能で
あった。
Phe-1、PHE-3プライマーペアー・・・・・・・・670bp
Phe-5、PHE-9プライマーペアー・・・・・・・・720bp
この内、Phe-1、PHE-3フライマーペアーで増幅された領域の遺伝子解読の結果、TCE分解活性値の違い如何にかかわらず、フェ
ノールハイドロキシラーゼのαサブユニット領域である2箇所のDEXRH配列はすべての菌株に保存されていることが分かった。
さらに、これらの遺伝子情報を基に系統解析を行った結果、TCE分解活性に対応した3つの菌株群が分類された。
以上の結果から、
① フェノールハイドロキシラーゼのαサブユニット領域がTCEに対する基質親和性と関連していること
② 本領域の利用により、フェノール資化性TCE分解菌の遺伝的検出および追跡が可能であること
③ 本領域を遺伝子置換することで、より強力なTCE分解菌の作出が可能であること
が示唆された。
平成10年度にはこれらの結果を詳細に検討し、TCE分解活性に対応した3つの菌株群それぞれに特異的に保存されているアミ
ノ酸基を見出した。これを基にフェノール資化性細菌群を分類するプライマーが開発された。
① 全フェノール資化性細菌群検出用プライマー(610bp)
Phe-200
Phe-3DD
② 高親和性フェノール資化性細菌群検出用プライマー(550bp)
Phe-200
HDB
③ 中親和性フェノール資化性細菌群検出用プライマー(600bp)
Phe-200
MLDB
④ 低親和性フェノール資化性細菌群検出用プライマー(470bp)
Phe-200
LDB
これらのプライマーを用いて汚染サイトの飽和帯土壌から抽出したDNAを競合PCRにかけ、同時に培養法と比較した結果、満
足のいく結果が得られた。即ち、分子生物学的手法により飽和帯土壌中のフェノール資化性細菌数を群集レベルで測定するこ
とが可能となったのである。
2.フェノール資化性細菌の分離と培養(生物工学研オリジナル)
遺伝子検出試験にあたっては、検出しようとする遺伝子が確実に入手されていることが必要である。標的遺伝子がないまま
に試験を繰り返しても、その結果が適正であるか否かは判らない。従って、フェノール資化性細菌の遺伝子検出を検討するに
当っては、フェノル資化性細菌そのものを分離培養する必要がある。
(1)使用培地
NEDO研究報告にある培地は、どのように調製しても沈殿を起こしたので、K2HPO4をKH2PO4に、またFeCl3をFe(Ⅲ)EDTAに変え、
改変フェノール利用細菌選択培地とした。これに20mgのフェノールを添加した。フェノールの初期添加量は標準の1/10である。
本培地においてもpH調整時において微妙な沈殿が生じる。
表2−1 改変フェノール利用細菌選択培地

(2)汚染試料
生物工学研排水溝中のヘドロを約1g/ι添加
(3)培養系の設定
1ι三角フラスコ3個に未滅菌のフェノール利用細菌選択培地500mιとフェノール10mgを添加し、攪拌した。これに汚染試
料として生物工学研排水溝中のヘドロを約1g/ι添加し、パラフィルムで密閉した。
(4)粗分離培養経過
恒温室(18℃)で静置培養し、その後の変化を追った結果、培養4日後には明らかに黄白色沈殿物が増加し、培養6日後に
はフラスコ壁面を白い膜が被う状態となった。この時点でパラフィルムを開封すると、フェノールの臭いは消失していた。こ
のことより、フラスコ内にはフェノール分解細菌が増殖しているものと考えられた。

写真2−1 培養6日の粗分離培養状況
(5)選択分離培養
粗分離培養によってフェノール分解細菌の存在が期待されたので、この試料を元に選択分離培養に移行した。
500mι三角フラスコ3個に未滅菌のフェノール利用細菌選択培地250mιとフェノールが200mg/ιとなるように調製した(表2−2)。
接種試料は予備培養①の培養液を1mι添加した。接種後パラフィルムで密閉した。培養は恒温室内18℃で静置して行った。
表2−2 分離培養に使用した改変フェノール利用細菌選択培地

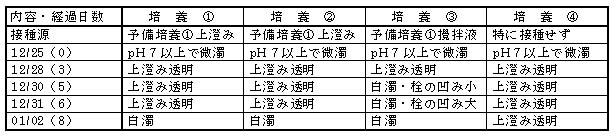
調製直後の培地はpH7以上で微濁したが、1日以内にこれらは微量の沈殿物となって沈降し、培養上澄み液は無色透明となった。
培養3日後には培養③のパラフィルムが内部に凹み始め、6日後には内部に大きく凹んだ。このため開封して空気を補給後、密閉した。
培養③は予備培養液を攪拌して接種しているが、培地500mιに対して1mιを接種しているに過ぎず、フェノール以外の大量の
炭素源は持ち込まれていない。また、栓としてのパラフィルムの過剰な凹みは分圧の2割を占める酸素を吸収している可能性が高い。
従って培養③の白濁本体はかなり純粋なフェノール資化性細菌である可能性が高い。但し、この反応が18℃と言った低温で5日程度
の短期間に現れているところに未だ疑問の余地がある。
フェノール分解細菌と思われる白濁は、9日を経過すると急激に沈降した。標的遺伝子検出までの7ヶ月間、2回のフェノール
200mg/ι添加を行ったが、25℃では接種3〜4日でピークを迎え、いずれもフェノール臭は消失した。
表2−3 選択分離培養の初期経過
3.フェノール資化性細菌遺伝子検出の実際(生物工学研実施)
3−1.プライマーの調製と保存
(1)フェノール資化性細菌検出プライマー
フェノール資化性細菌のTCE分解能力は高・中・低の3つに分類でき、検出可能遺伝子は、
① 全フェノール資化性細菌
② TCE高親和性フェノール資化性細菌
③ TCE中・低親和性フェノール資化性細菌
④ TCE低親和性フェノール資化性細菌
に分けられる。検出プライマーは、『平成10・11年度NEDO研究報告書』並びに『NEDO最終成果報告書』に記載されている。尚、
プライマー1(phe-200)はすべてに共通である。
表3−1 NEDO報告にあるフェノール資化性細菌検出プライマーのヌクレオチド配列

※ 転記ミスチェック済み
(2)合成依頼
プライマー合成は日本バイオサービスに依頼した。
(3)プライマーの調製
プライマーは100pmol/μιで使用するのが普通である。また、凍結・解凍を避けるために小分けして凍結保存することが望ましい。
そこで合成されたプライマーが100pmol/μιとなるようTEバッファーを用いて希釈し、10〜20μιに小分けして凍結保存した。例え
ばphe-200の場合、合成成績書には全量7.7(ODU)、254.1μg、33.9nmolと記載されているので、100pmol/μιに必要なTE液量は
339μιとなる。
3−2.DNAの抽出
(1)抽出キット
今回は予備試験であるため、ニッポンジーンのISOPLANTサンプル配布を用いた。
(2)抽出操作
ISOPLANTキットによるDNA抽出は極めて操作の少ない方法であるが、培養コロニーからの抽出を前提としているため、フローの前段
に集菌操作を加える必要がある。今回の試験ではフェノール資化性細菌予備培養液10mιを遠心分離して沈降させ、これをSampleとし
て扱った。
遠心分離は10mι遠心管で3500rpm,15分行うことで菌体を集菌可能であった。標的試料が水である場合は濃縮倍率を高く設定するこ
とでこの方法が適用できるものと思われる。
3−3.サーマルサイクラーの設定とプロトコール
(1)使用サーマルサイクラー
サーマルサイクラーはTaKaRa TP400を使用した。本機は200μιチューブ用の小型機である。特徴としては蒸発防止用のミネラルオ
イルの添加が不必要であるが、プログラムの設定は5パターン、5セグメントの入力が限界である。
(2)PCRプロトコール
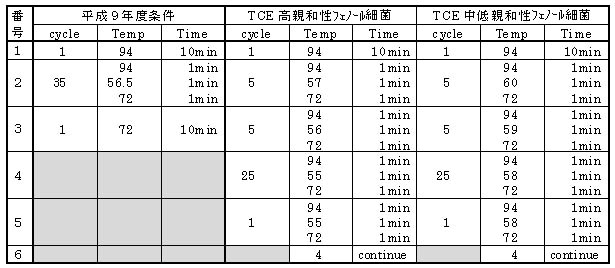
先述のようにフェノール資化性細菌のTCE分解能力は高・中・低の3つに分類でき、NEDO研究報告書ではTCE高親和性並びにTCE中低
親和性フェノール細菌のPCRプロトコールが明記されている。一方、全フェノール資化性細菌検出のPCRプロトコールについては記載
がない。そこで、フェノール資化性細菌の検出にあたってはすべてのプロトコールについて確認することとした。
表3−2 全フェノール資化性細菌以外のPCR反応条件(NEDO研究報告書より)
(3)プログラミングの概要
ここではTaKaRa TP400を使用した場合のプログラミングの概要を記す。
表3−3 TaKaRa TP400でのプログラム設定内容

先述のようにTaKaRa TP400では一つのプログラムの設定は5パターン、5セグメントの入力が限界であるので、入力前の確認
が必要である。ここで言うパターンは表3−2の番号(サイクルの種類)に相当し、セグメントはサイクル内の条件設定数に相
当する。従って『平成9年度条件』では3パターン1〜3セグメントであるが、『TCE高・中低親和性』の場合はそのまま入力す
ると6パターン1〜3セグメントとなってしまう。ところが両プロトコール共に、パターン4と5は同じであり、パターン4を
26サイクルとすればよい。またパターン6の4℃continueは別に無くても構わないサイクルであり、設定する場合は前のパター
ンの最後に付けることもできる。このことを念頭に整理すると『TCE高・中低親和性』のプログラムは4パターン1〜5セグメン
トとなる。
3−4.PCRの操作
PCRの操作は基本的にDNA増幅に係る試料、酵素、プライマーを調製し、サーマルサイクラーにかける操作である。
(1)基本的事項
PCRに際しての基本的事項を次のように定めた。
① 反応試薬類の調製はクリーンルーム内で行う。クリーンルームがない場合でもコンパトメントメントで外囲と分ける。
② ポジコンとネガコンを考慮する。
③ 鋳型DNAは最後に加える。
④ 1μι以下の少量試薬を加える場合はピペッティング操作を行う。
⑤ 調製の最後にマイクロチューブを十分撹拌する。
これ以外にも基本的に定める事項はあろうが、施設の条件によっても異なる内容であり、各自が検討すべきである。
(2)反応試薬類の調製
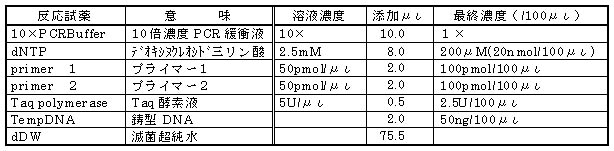
NEDO研究報告書のミス記載を修正したフェノール資化性細菌のPCR反応液組成を下表に示した。NEDO報告にあるPCR反応液の
組成はメタン資化性細菌、フェノール資化性細菌共に共通である。
表3−4 フェノール資化性細菌のPCR反応液組成(NEDO研究報告書より改変・訂正)
今回の予備試験では当初、2年前の酵素液を使用していたが、増幅結果に再現性が低い結果となった。2年前のTaq酵素液
を使い果たした際、増幅の安定を求めて新製品であるEx Taqに切り替えた結果増幅結果が安定した。また、NEDO報告では反
応液量を100μιとしているが、この量は試薬の浪費につながるばかりか反応液の温度変化に時間を要する。要するに反応液
量を100μιとする意味がないのである。いくつかの実験検討の結果、反応液量は50μιで十分であった。液量を更に減らす
ことも可能であるが、Taq酵素の分取限界があり、ここでは50μιを採用すべきとの結論に達した。
現段階で増幅に支障のない反応試薬組成と添加順序は下表の様である。
表3−5 PCR増幅が可能な反応液組成
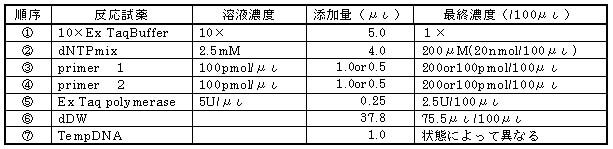
※ポジコンは標準遺伝子をTempDNAの代わりに添加
※ネガコンはdDWをTempDNAの代わりに添加
(3)サーマルサイクラーの運転
サーマルサイクラーの電源を入れ、20分以上ランニング運転する。所定のプロトコールをロードしてマニュアルにしたがっ
て操作する。PCRの所要時間は以下の様である。
表3−6 各プログラムと実際の所要時間

3−5.アガロースゲルの作成
(1)ゲルの濃度と量
アガロースは標的遺伝子の大きさによって選択することとされており、今回の標的遺伝子400〜600bpの低分子ではアガロ
ースSを選定した。ゲル濃度も同様に標的遺伝子の大きさで選択するが、今回は1〜2%の範囲で試験検討した。
電気泳動槽内に固化させるゲルの大きさは58×88×3mmであり、1枚当たり最低15mιの容量となる。今回は2mm〜
5mmの厚さで試験検討した。
扱いやすさと経済性を考慮した結果、アガロース濃度は1.5%、厚さは4mm程度が適当である。従ってゲル1枚当たりの
容量は20mιである。
(2)薬剤と調製
電気泳動バッファーはTBEbufferを選定した。このバッファーは電気泳動の電解液であり、同時にゲル調製の溶媒である。
今回は5倍濃度の5×TBEをストック液とした。また使用にあたっては0.5×TBEとして10倍希釈して使用した。
(3)ゲルの作成
大きめの三角フラスコにTBEbufferとアガロースを入れ、穴あきサランラップで閉じてこれを電子レンジにかける。吹きこ
ぼしがあるのでスイッチを数回操作すると吹きこぼしがなくなり完全溶解する。
三角フラスコを少し冷まし(90℃)、これにEtBr(エチジウムブロマイド)が0.1μg/mιとなるように加えて撹拌する。
EtBrは100ppmストック液を調製しておくと便利である。尚、EtBrは発ガン性物質であるので、使用ピペットや容器、その後
の扱い等を検討しておく必要がある。
アガロースの溶液は放置するとゲル化するので80℃程度に保つか冷めない内に泳動槽やゲル作成槽に流し込む。
3−6.電気泳動の操作
(1)LoadingBufferとの混合
電気泳動を行うにあたっては、PCRによる増幅産物とLoadingBufferを混合する必要がある。この混合には2つの意味がある。
一つ目は泳動状態を確認することである。増幅遺伝子は透明であるため、電気泳動の進捗状況が分らない。LoadingBufferには
色素が混入されているため、遺伝子がどのあたりを泳動しているかの目安になる。もう一つには遺伝子の拡散を防止する意味が
ある。LoadingBufferにはグリセリンが混入されているため、遺伝子は重たくなり、ゲルから出れなくなる。
混合はLoadingBuffer1μι:増幅遺伝子液5μιが都合がよい。マイクロピペットを用いてピペッティングで撹拌する。
増幅遺伝子の大きさを確認するために必ずマーカー遺伝子を用意する。今回のマーカーは100bp DNA Ladderを用いた。この
マーカーは100〜1500bpをカバーするマーカーである。
(2)ゲルへの注入
混合液5μιをゲルのポアに注入する。この場合、参考書には電気泳動バッファーを所定量加えた後にゲルに注入することに
なっているが、これではゲルの水深が分らず、混合液をポアに注入できないことが多い。生物工学研では電気泳動バッファーを
ゲル上に薄く敷き、この状態で注入し、最後に電気泳動バッファーを所定量注入する方法を採っている。この方法では注入ミス
はない。
(3)荷電
TBEbufferを用いた加電圧は、ゲル長1cm当たり10VまたはLoadingBufferが30分から60分でゲルの2/3に達する程度とされて
いる。今回の試験検討の結果、100V−60分が適当であった。尚、単純な確認の場合は30分でも構わない。
(4)泳動パターンの確認
遺伝子の泳動を確認するためにはトランスイルミネーターが必要である。イルミネーターのガラス窓にサランラップ
(旭化成のサランラップが最も優れている)を敷き、この上に泳動が終了したゲルを載せて紫外線ランプを点灯する。
増幅された遺伝子がある場合は発光バンドが浮かび上がる。発光強度を強くしたい場合はゲル作成時のEtBr濃度を2倍以上に高める。
(5)泳動パターンの記録
一般に泳動パターンは専用撮影装置によって記録する。これは証明が必要な場合や発表する場合に必要だが、社内研究段階では
ノートに記録すればよい。この場合、マーカー遺伝子のパターンを記入したデータシートを用意しておくと便利である。
今回の検討では基本的にはノートに記録したが、試みとしてEtBr濃度を2倍に上げ、発光パターンをビデオカメラに収めた後、
画像処理によってパターンを引き出した。これによって発光パターンを記録できるようになった。下の写真はALL-FHE-1のプロト
コールによって増幅した標的遺伝子の泳動パターンである。470bpのTCE低親和性フェノール細菌は3試料共に多く存在することが
分る。600bpのTCE中・低親和性フェノール細菌は培養試料①に存在することが分る。550bpのTCE高親和性フェノール細菌はこのプ
ロトコールでは明確に増幅されていない。

図3−1 ALL-FHE-1によって増幅した各試料、各細菌遺伝子の泳動パターン
3−7.泳動パターンと評価
(1)全フェノール資化性細菌遺伝子の検出検討
全フェノール資化性細菌遺伝子の検出は予備試験を兼ねて実施した。試験は全11試験、Negaconを含む38試料について行った。
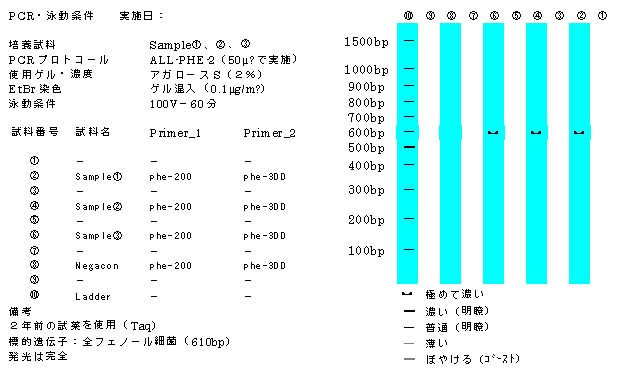
図3−2 第6回試験の例(Sample①、②、③の全フェノール細菌検出を目標:成功)
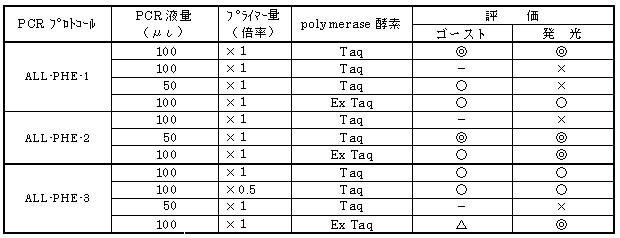
【まとめ】
全フェノール細菌検出結果のまとめを下表に示した。一連の検討結果から以下の結果が導かれる。
① 分離培養試料①〜③のすべてにフェノール資化性細菌が存在する。
② 分離培養試料②にはフェノール資化性細菌が相対的に少ない。
③ Taq酵素は増幅の安定性に欠ける。
④ Ex Taq酵素は増幅が安定している。
⑤ Ex Taq酵素によるALL-PHE-3増幅はゴーストが多い。
以上の結果およびその後の試験結果より、全フェノール資化性細菌の検出にはEx Taq酵素を用いたALL-PHE-2のプロトコール
が適している。また、経済性の面から、PCR液量は50μιが適している。
表3−7 全フェノール細菌検出結果のまとめ
(2)高、中・低親和フェノール資化性細菌遺伝子の検出検討
TCE高、中・低親和フェノール資化性細菌遺伝子の検出は全7試験、Negaconを含む54試料について行った。

図3−3 第2回試験の例(Sample①、②、③のTCE高、中・低親和性フェノール細菌検出を目標)
【まとめ】
TCE親和性フェノール細菌検出結果のまとめを下表に示した。一連の検討結果から以下の結果が導かれる。
① 分離培養試料①〜③のすべてにTCE低親和性フェノール資化性細菌が存在する。
② 分離培養試料②、③にはTCE中親和性フェノール資化性細菌が存在しない。
③ ALL-PHE-1は中、低の増幅に適用可能であるが、高ではゴーストを生じる。
④ ALL-PHE-2は高、中、低すべてに適用可能である。
⑤ ALL-PHE-3は中の増幅が不安定である。
以上の結果およびその他の検討結果より、TCE親和性フェノール資化性細菌の検出にはALL-PHE-2のプロトコールが
適している。また、経済性の面から、PCR液量は50μιが適している。
表3−8 TCE親和性フェノール細菌検出結果のまとめ
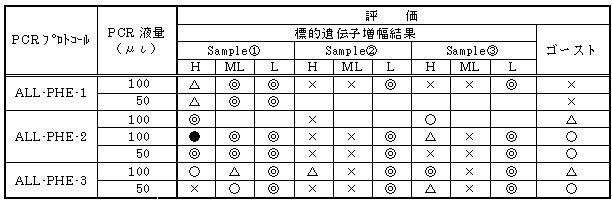
※H:高親和性 ML:中・低親和性 L:低親和性
※●は400bp付近にゴーストあり、標的は増幅している
4.確認試験(生物工学研実施)
4−1.フェノール資化性細菌の保存培養と鋳型遺伝子
(1)フェノール資化性細菌保存培地の検討
分離培養したフェノール資化性細菌は、遺伝子の面からもその存在が確認できたので、培地作成時の沈殿を避
ける目的で有機塩によって培地を再構成した。この組成では培地調製時の沈殿は起きなくなった。
表4−1 フェノール利用細菌保存培地(生物工学研)

この培地に、当初分離培養していた培養①、②、③より①、②を接種したところ、25℃では12時間以内に肉眼
的増殖が確認された。そこで、その後の培養では培養①由来株をPHE0410−①、培養②由来株をPHE0410−②とし
て扱うこととした。
(2)鋳型遺伝子の抽出
培養4日後の対数期を過ぎたPHE0410−①、PHE0410−②を、3−2の方法で鋳型遺伝子抽出に供した。
4−2.遺伝子検出確認試験
これまでの検討結果に従って抽出遺伝子をPCRにかけた。
(1)全フェノール資化性細菌(610bp)
②レーンにPHE0410-①が強く検出されている。③レーンのPHE0410-②はミスがあり、再試験の結果、PHE0410-①
と同様に検出された。
(2)高TCE親和性細菌(550bp)
④、⑤レーンに約400bpのバンドが検出されているが、これは高TCE親和性細菌のものではない。以前の検討結果
から推測するとゴーストである。従って現試料中には検出可能量の高TCE親和性細菌は存在しない。但し以前の試験
では検出されているので高TCE親和性細菌は存在しているはずである。おそらくはフェノールが欠乏する時期に増殖
してくるものと思われる。
(3)中・低TCE親和性細菌(600bp)
⑥、⑦レーンに検出されている。⑦レーンのPHE0410-②はかなり弱いバンドであるが、存在は明らかである。
(4)低TCE親和性細菌(470bp)
⑧、⑨レーンに強く検出されている。フェノール資化性細菌の大半はこの低TCE親和性細菌であることがNEDOの研
究報告にも述べられている。
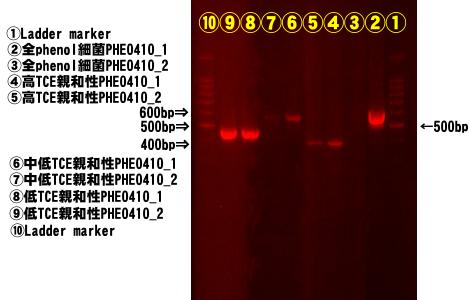
図4−1 遺伝子検出確認試験によって検出されたバンド





















