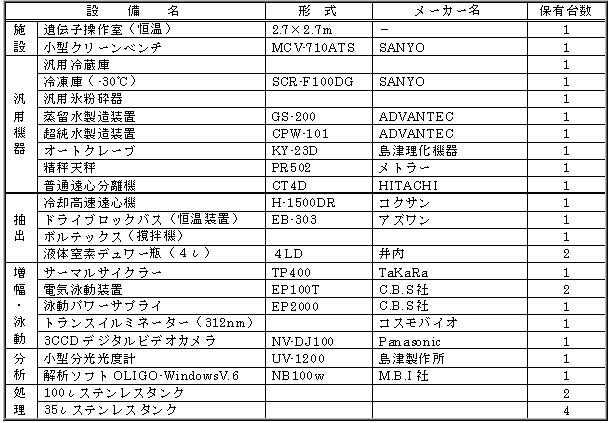
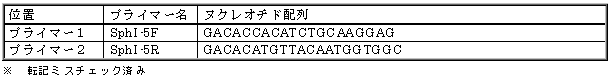
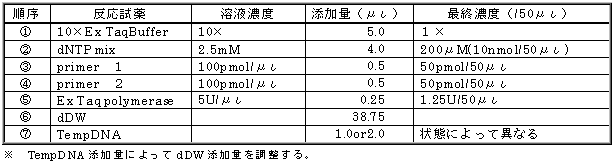
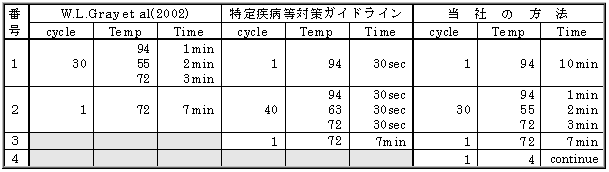
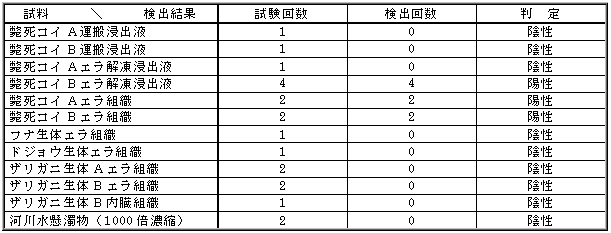
|
KHV(コイヘルペスウィルス)PCR一次検査申込書 |
 |
お問合せページへ |
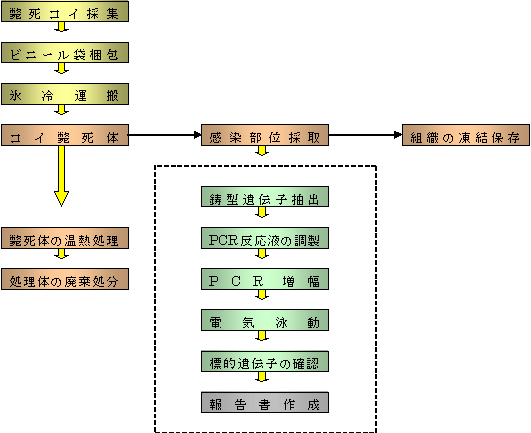
| 【ネガティブコントロール】 操作中にKHV遺伝子が試料外から混入していないことを証明するためのサンプルで、抽出遺伝子の代わりに滅菌した超純水を 加えます。このサンプルで遺伝子が検出された場合は、反応液の調製からやり直しとなります。 【ポジティブコントロール】 KHV遺伝子が確実に入ったサンプルのことです。このサンプルで遺伝子が検出されなかった場合は、反応液の調製に失敗した か増幅に失敗したことを意味します。反応液の調製からやり直しとなります。 |